
Dal punto di vista clinico il MM comporta la possibilità di un danno a carico di diversi organi (quali lesioni osteolitiche e insufficienza renale) e una significativa immunosoppressione con aumentato rischio di infezioni. Il sospetto di MM sorge, generalmente, in seguito al riscontro di una Componente Monoclonale all’elettroforesi delle proteine sieriche o delle proteine urinarie [fig.2].
Tale riscontro può essere più o meno casuale, a seconda che avvenga nell’ambito di accertamenti di routine in pazienti asintomatici, piuttosto che in seguito ad un sospetto clinico (dolori ossei, fratture patologiche, anemia non carenziale, insufficienza renale, proteinuria, ipercalcemia).
Fig. 1 Plasmacellule mielomatoseIl processo diagnostico si articola su diversi livelli:
- Esami ematochimici e sulle urine.
- Aspirato Midollare e/o Biopsia Osteomidollare (analisi delle alterazioni morfologiche, cariotipiche e molecolari delle plasmacellule).
- Esami Radiologici (radiografia dello scheletro in toto, in tempi recenti quasi del tutto sostituita da metodiche più sofisticate e sensibili quali TC, RMN e PET).
Diversi fattori possono incidere sulla prognosi:
- Fattori prognostici correlati all’ospite: età avanzata (≥75 anni), insufficienza renale pre-esistente, altre comorbidità, infezioni.
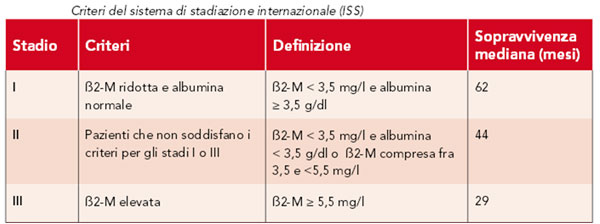
- Fattori prognostici correlati alla massa tumorale, che si riflettono nei sistemi di stadiazione utilizzati: Durie e Salmon (il primo a diffondersi) e ISS (più recente) [fig.3]
- Fattori prognostici correlati alla presentazione della malattia e alle sue complicanze: insufficienza renale causata dal MM, malattia extramidollare, leucemizzazione alla diagnosi.
- Fattori prognostici correlati alla biologia del mieloma: anomalie cromosomiche nelle plasmacellule mielomatose caratterizzano un mieloma più aggressivo e con una prognosi peggiore. Questo quadro negli ultimi anni sta cambiando profondamente dopo l’introduzione dei “nuovi farmaci” che spesso annullano il ruolo prognostico negativo della maggior parte delle anomalie cromosomiche.
La terapia va iniziata in presenza di un MM “sintomatico” cioè in presenza di danno d’organo (anemia con emoglobina < 10 gr/ dl, ipercalcemia, insufficienza renale con creatinina > 2 mg/dl,lesioni osteolitiche).
Negli ultimi anni sono stati fatti significativi progressi nel trattamento del MM, sia nel paziente giovane (età inferiore o uguale ai 65 anni) che nel paziente anziano. La terapia viene differenziata in base, innanzitutto, dell’età del paziente.
Paziente giovane
Nel paziente giovane, la terapia standard comprende un’induzione di 3-4 cicli, seguita da chemioterapia per la mobilizzazione e la raccolta delle cellule staminali emopoietiche periferiche e successivo trapianto autologo delle cellule staminali (ASCT), preceduto da una chemioterapia ad alte dosi, mieloablativa, definita “condizionamento”.
Nel nuovo millennio i “nuovi farmaci”, gli immunomodulanti (lenalidomide e talidomide) e l’inibitore del proteasoma (bortezomib), sono stati variamente ed efficacemente combinati tra loro e/o con desametasone o agenti chemioterapici convenzionali per formare nuove associazioni a 2, 3, e persino 4 farmaci, che hanno dimostrato una chiara superiorità rispetto ai regimi tradizionali utilizzati in induzione.
Da diversi studi clinici deriva che la terapia di induzione dovrebbe essere costituita preferenzialmente da un regime a 3 farmaci comprensivo di bortezomib per un totale di 4-6 cicli somministrati prima della rac- colta delle cellule staminali ematopoietiche e del successivo ASCT.
Il doppio ASCT, ciascuno preceduto da due somministrazioni di chemioterapia ad alte dosi, ha dimostrato, rispetto al singolo ASCT, una superiorità in termini di prolungamento della sopravvivenza libera da progressione (PFS), anche se non accompagnato da chiari vantaggi in termini di percentuale di risposta completa (CR) e di prolungamento della sopravvivenza globale (OS).
Nel corso degli ultimi anni numerosi studi sono stati disegnati con l’obiettivo di investigare il ruolo dei nuovi farmaci, dopo ASCT, come terapia di consolidamento, di breve durata, finalizzata ad incrementare la frequenza e la profondità della risposta precedentemente ottenuta. Nonostante i dati di studi preliminari, la terapia di consolidamento non può ancora essere considerata uno standard di trattamento e il suo impiego dovrà essere validato dai risultati di studi clinici in corso.
Paziente anziano
Circa due terzi dei pazienti di nuova diagnosi hanno un’età superiore a 65 anni e questo limite di età, seppure arbitrariamente, viene utilizzato per identificare i pazienti che sono, o non sono, candidati a ricevere un programma di terapia ad alte dosi con successivo trapianto autologo di cellule staminali ematopoietiche (ASCT).
Negli ultimi anni, talidomide, bortezomib e lenalidomide sono stati introdotti anche nei regimi di trattamento dei pazienti anziani, in combinazione con i chemioterapici convenzionali. Nel paziente anziano, non candidabile all’ASCT, la terapia standard include un’induzione di 9 cicli con melfalanprednisone-talidomide o melfalanprednisone-bortezomib.
Sia nel paziente giovane che nell’anziano si sta valutando il ruolo di una terapia continuativa (o di mantenimento) con nuovi farmaci come strategia per un controllo a lungo termine della malattia, in grado di mantenere le risposte ottenute, ottimizzare la remissione, ridurre le probabilità di recidiva e, in ultimo, prolungare la sopravvivenza. Il mantenimento della risposta ottenuta è particolarmente importante nei pazienti anziani, che non possono giovarsi del ASCT, e in cui risulta più difficoltoso scegliere la terapia ottimale da utilizzare alla recidiva, sia a causa dell’età che delle comorbilità di cui spesso soffrono.
Con l’avvento dei nuovi farmaci diversi studi randomizzati sulla terapia di mantenimento hanno evidenziato un vantaggio in termini di risposta, sopravvivenza libera da progressione (progression-free survival, PFS) e, in alcuni casi, sopravvivenza globale (overall survival, OS). Dai dati disponibili sembrerebbe che una terapia continuativa con questi farmaci sia ben tollerata e possa portare a risposte migliori oltre che ad una maggiore durata delle stesse. Tuttavia alla luce dei dati attuali e della mancanza di un chiaro prolungamento della OS in molti di essi, non è possibile raccomandare l’esecuzione routinaria, al di fuori di studi clinici, della terapia di mantenimento. Sono necessari ulteriori studi e follow-up più lunghi per confermare l’efficacia dei nuovi farmaci utilizzati nei regimi di mantenimento, per suggerirne il migliore utilizzo, sia in termini di dosaggio che di durata del trattamento, per ottimizzare l’efficacia e ridurre la tossicità, sia nei pazienti giovani che nella popolazione anziana.
Infine bisogna considerare che le nuove molecole hanno un profilo di tossicità diverso tra di loro e rispetto ai farmaci convenzionali. La scelta della migliore terapia per il singolo paziente si dovrà basare quindi oltre che sui dati scientifici di efficacia e sulle caratteristiche biologiche, età e comorbidità del paziente, anche sul profilo di tossicità dei regimi terapeutici. Iniziando un trattamento specifico è necessario tenere presente la possibile insorgenza di tossicità ematologica (anemia, neutropenia o piastrinopenia) e/o tossicità non ematologiche come neuropatie, trombosi, alterazioni metaboliche, insufficienza renale, infezioni e disturbi gastroenterici. È indispensabile scegliere per ciascun paziente il miglior regime terapeutico bilanciando la sua efficacia con la sua tossicità.
Le prospettive future sono costituite da tutta una serie di nuove molecole quali la pomalidomide (derivato degli immunomodulanti talidomide e lenalidomide), gli inibitori del proteasoma di seconda generazione carfilzomib, ixazomib e oprozomib, gli anticorpi monoclonali elotuzumab, daratumumab e pembrolizumab.
Tali molecole sono state messe a punto e vengono studiate (singolarmente o in varie associazioni) con l’obiettivo di ottenere maggiore efficacia e tolleranza, con minore tossicità.
Accursio Fabio Augello
